روش ساخت تگزاپن+آموزش تولید اسید سولفونیک
روش ساخت اسید سولفونیک
فرمول تولید آسان تگزاپن
روش ساخت تگزاپن با کیفیت پاکسان
آیا می دانید با ساده ترین امکانات میتوانید تولید کننده تگزاپن و اسید سولفونیک باشید؟
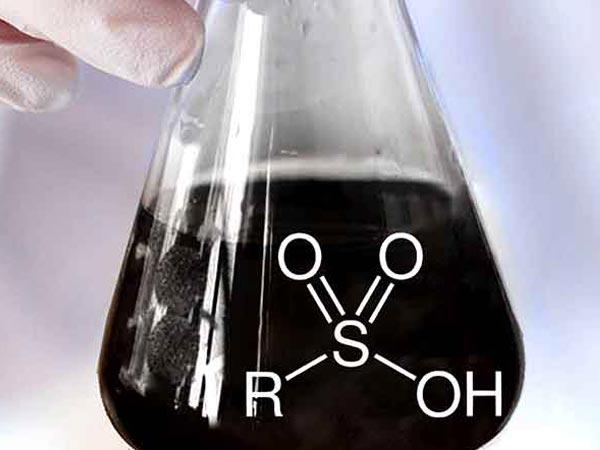
 اسید سولفونیک (یا اسید سولفونیک ) به عضوی از کلاس ترکیبات آلی گوگردی با فرمول کلی R-
اسید سولفونیک (یا اسید سولفونیک ) به عضوی از کلاس ترکیبات آلی گوگردی با فرمول کلی R-
S(=O) 2 -OH اطلاق می شود که در آن R یک گروه آلکیل یا آریل آلی و S(=O) 2 است. (OH) گروه سولفونیل هیدروکسید. [1] به عنوان یک جایگزین، به عنوان یک گروه سولفو شناخته می شود . یک اسید سولفونیک را می توان به عنوان اسید سولفوریک در نظر گرفت که یک گروه هیدروکسیل با یک جایگزین آلی جایگزین شده است. ترکیب اصلی (با جایگزینی آلی با هیدروژن) اسید سولفونیک اصلی، HS(=O) 2 است.(OH)، یک توتومر اسید سولفوردار ، S(=O)(OH) 2 . [2] نمک ها یا استرهای اسیدهای سولفونیک سولفونات نامیده می شوند .
ساختار کلی یک اسید سولفونیک با گروه عاملی با رنگ آبی نشان داده شده است
مدل توپ و چوب متان سولفونیک اسید.
اسیدهای آریل سولفونیک از طریق فرآیند سولفوناسیون تولید می شوند . معمولاً عامل سولفون ساز تری اکسید گوگرد است . کاربرد وسیع این روش تولید اسیدهای آلکیل بنزن سولفونیک است :
RC 6 H 5 + SO 3 → RC 6 H 4 SO 3 H
در این واکنش تری اکسید گوگرد یک الکتروفیل و آرن نوکلئوفیل است. این واکنش نمونه ای از جایگزینی معطر الکتروفیل است. [1]
اسیدهای آلکیل سولفونیک را می توان با روش های مختلفی تهیه کرد. در سولفوکسیداسیون ، آلکان ها با مخلوطی از دی اکسید گوگرد و اکسیژن تحت تابش قرار می گیرند . این واکنش به صورت صنعتی برای تولید اسیدهای آلکیل سولفونیک استفاده می شود که به عنوان سورفکتانت استفاده می شود . [3]
RH + SO 2 + 0.5 O 2 → RSO 3 H
واکنش مستقیم آلکان ها با تری اکسید گوگرد معمولاً مفید نیست، به جز برای تبدیل متان سولفونیک اسید به متان دی سولفونیک اسید .
بسیاری از اسیدهای آلکان سولفونیک را می توان با افزودن بی سولفیت به آلکن های انتهایی به دست آورد. بی سولفیت همچنین می تواند توسط آلکیل هالیدها آلکیله شود : [3]
HSO 3 − + RCH=CH 2 + H + → RCH 2 CH 2 SO 3 H
HSO 3 - + RBr → RSO 3 H + Br -
اسیدهای سولفونیک را می توان با اکسیداسیون تیول ها تهیه کرد:
RSH + 3 ⁄ 2 O 2 → RSO 3 H
این مسیر اساس بیوسنتز تورین است.
بسیاری از اسیدهای سولفونیک با هیدرولیز سولفونیل هالیدها و پیش سازهای مرتبط تهیه می شوند. بنابراین، اسید پرفلوئورواکتان سولفونیک با هیدرولیز سولفونیل فلوراید تهیه می شود که به نوبه خود از الکتروفلوئوراسیون اسید اکتان سولفونیک تولید می شود. به طور مشابه، سولفونیل کلرید حاصل از پلی اتیلن به اسید سولفونیک هیدرولیز می شود. این سولفونیل کلریدها توسط واکنش های رادیکال آزاد کلر، دی اکسید گوگرد و هیدروکربن ها با استفاده از واکنش رید تولید می شوند .
وینیل سولفونیک اسید از هیدرولیز کربیل سولفات (C 2 H 4 ( SO 3 ) 2 ) به دست می آید که به نوبه خود با افزودن تری اکسید گوگرد به اتیلن به دست می آید .
اسیدهای سولفونیک اسیدهای قوی هستند. آنها معمولاً به عنوان یک میلیون بار قوی تر از اسید کربوکسیلیک مربوطه ذکر می شوند. به عنوان مثال، اسید p -Toluenesulfonic و اسید متان سولفونیک دارای pKa به ترتیب 2.8- و 1.9- هستند، در حالی که مقادیر اسید بنزوئیک و اسید استیک به ترتیب 4.20 و 4.76 هستند. با این حال، به عنوان یک نتیجه از اسیدیته قوی آنها، مقادیر pKa آنها را نمی توان به طور مستقیم اندازه گیری کرد، و مقادیری که معمولاً نقل قول می شوند باید به عنوان تخمین های غیر مستقیم با عدم قطعیت قابل توجه در نظر گرفته شوند. به عنوان مثال، منابع مختلف p K a را گزارش کرده انداسید متان سولفونیک تا 0.6- [4] یا به اندازه 6.5- باشد. [5] اسیدهای سولفونیک با کلرید سدیم جامد ( نمک ) واکنش می دهند و سولفونات سدیم و کلرید هیدروژن را تشکیل می دهند. [6] این خاصیت دلالت بر اسیدیته ای در دو یا سه مرتبه از اسیدیته HCl (g) دارد که pKa آن اخیراً به دقت تعیین شده است ( pKaq = -5.9) .
اسیدهای سولفونیک به دلیل قطبیت خود، معمولاً جامدات کریستالی یا مایعات چسبناک و با جوش زیاد هستند. آنها همچنین معمولا بی رنگ و غیر اکسید کننده هستند، [7] که آنها را برای استفاده به عنوان کاتالیزور اسیدی در واکنش های آلی مناسب می کند. قطبیت آنها، همراه با اسیدیته بالای آنها، اسیدهای سولفونیک با زنجیره کوتاه را محلول در آب می کند، در حالی که اسیدهای با زنجیره بلندتر خاصیت شوینده مانندی از خود نشان می دهند.
ساختار اسیدهای سولفونیک توسط نمونه اولیه اسید متان سولفونیک نشان داده شده است . گروه اسید سولفونیک، RSO 2 OH دارای یک مرکز گوگرد چهار وجهی است، به این معنی که گوگرد در مرکز چهار اتم قرار دارد: سه اکسیژن و یک کربن. هندسه کلی مرکز گوگرد یادآور شکل اسید سولفوریک است .
-
نماینده اسیدهای سولفونیک و سولفونات ها
تائورین ، یک اسید صفراوی ، و یکی از معدود اسیدهای سولفونیک طبیعی (که در توتومر غیر معمول نشان داده شده است ).
PFOS ، یک سورفکتانت و یک آلاینده بحث برانگیز.
p - اسید تولوئن سولفونیک ، یک معرف پرکاربرد در سنتز آلی.
Nafion , یک اسید سولفونیک پلیمری مفید در پیل های سوختی .
سدیم دودسیل بنزن سولفونات، یک سورفکتانت آلکیل بنزن سولفونات که در شوینده های لباسشویی استفاده می شود .
کوآنزیم-M یک کوفاکتور مورد نیاز برای بیوسنتز متان است که در گاز طبیعی یافت می شود .
اگرچه هر دو اسید آلکیل و آریل سولفونیک شناخته شده اند، اما بیشتر کاربردها با مشتقات معطر مرتبط هستند.
مواد شوینده و سورفکتانت ها مولکول هایی هستند که گروه های بسیار غیرقطبی و بسیار قطبی را ترکیب می کنند. به طور سنتی، صابون ها سورفکتانت های محبوبی هستند که از اسیدهای چرب به دست می آیند . از اواسط قرن بیستم، استفاده از اسیدهای سولفونیک در جوامع پیشرفته از صابون پیشی گرفته است. به عنوان مثال، تخمین زده می شود که سالانه 2 میلیارد کیلوگرم آلکیل بنزن سولفونات برای اهداف مختلف تولید می شود. لیگنین سولفوناتها که از سولفوناسیون لیگنین تولید میشوند، اجزای سیالات حفاری و مواد افزودنی در انواع خاصی از بتن هستند. [8]
بسیاری از رنگ های آنتراکینون ، اگر نه بیشتر، از طریق سولفوناسیون تولید یا پردازش می شوند. [9] اسیدهای سولفونیک تمایل دارند به پروتئین ها و کربوهیدرات ها متصل شوند . بیشتر رنگ های "قابل شستشو" اسیدهای سولفونیک هستند (یا گروه سولفونیل عملکردی در آنها وجود دارد) به همین دلیل. اسید p-Cresidine Sulfonic برای ساخت رنگ های غذایی استفاده می شود.
اسیدهای سولفونیک به عنوان اسیدهای قوی به عنوان کاتالیزور نیز استفاده می شوند . ساده ترین نمونه ها عبارتند از متان سولفونیک اسید ، CH3SO2OH و اسید p -toluenesulfonic ، که به طور منظم در شیمی آلی به عنوان اسیدهای چربی دوست (محلول در حلال های آلی) استفاده می شوند. اسیدهای سولفونیک پلیمری نیز مفید هستند. رزین Dowex مشتقات اسید سولفونیک پلی استایرن است و به عنوان کاتالیزور و برای تبادل یون ( نرم کننده آب ) استفاده می شود. Nafion ، یک اسید سولفونیک پلیمری فلوئوردار جزء غشاهای تبادل پروتون در پیل های سوختی است . [10]
داروهای سولفا ، دسته ای از آنتی باکتریال ها، از اسیدهای سولفونیک تولید می شوند.
سولفونات ها اساس اکثر رزین های تبادل یونی هستند که در نرم کردن آب استفاده می شوند.
لیگنوسولفونات
در فرآیند سولفیت برای کاغذسازی، لیگنین از لیگنوسلولز با پردازش تراشههای چوب با محلولهایی از یونهای سولفیت و بی سولفیت حذف میشود. این معرف ها پیوندهای بین اجزای سلولز و لیگنین و به ویژه در خود لیگنین را می شکافند. لیگنین به لیگنوسولفونات ها، آینومرهای مفید ، تبدیل می شود که محلول هستند و می توانند از الیاف سلولزی جدا شوند.
طرح ایده آل برای دپلیمریزاسیون لیگنین توسط فرآیند سولفیت
مقاله اصلی: واکنش سولفوناسیون
اسیدهای آریل سولفونیک به هیدرولیز حساس هستند، برعکس واکنش سولفوناسیون. در حالی که اسید بنزن سولفونیک در دمای بالای 200 درجه سانتیگراد هیدرولیز می شود، بیشتر مشتقات مرتبط آسان تر هیدرولیز می شوند. بنابراین، حرارت دادن اسیدهای آریل سولفونیک در اسید آبی، آرن اصلی را تولید می کند. این واکنش در چندین سناریو به کار می رود. در برخی موارد، اسید سولفونیک به عنوان یک گروه محافظ حل کننده آب عمل می کند، همانطور که با خالص سازی پارازایلن از طریق مشتقات اسید سولفونیک آن نشان داده شده است. در سنتز 2،6-دی کلروفنل ، فنل به مشتق اسید 4 سولفونیک خود تبدیل می شود، که سپس به طور انتخابی در موقعیت های کنار فنل کلر می شود. هیدرولیز گروه اسید سولفونیک را آزاد می کند. [11]
اسیدهای سولفونیک را می توان به استر تبدیل کرد . این دسته از ترکیبات آلی دارای فرمول کلی R-SO 2 - OR هستند. استرهای سولفونیک مانند متیل تریفلات عوامل آلکیله کننده خوب در سنتز آلی در نظر گرفته می شوند . چنین استرهای سولفوناتی اغلب با الکلیزاسیون سولفونیل کلریدها تهیه می شوند:
RSO 2 Cl + R'OH → RSO 2 OR' + HCl
هالوژناسیونویرایش کنید
گروه های سولفونیل هالید زمانی به وجود می آیند که یک گروه عاملی سولفونیل به تنهایی به یک اتم هالوژن متصل می شود. آنها دارای فرمول کلی R-SO 2 -X هستند که در آن X یک هالید و تقریباً همیشه کلرید است. آنها با کلرزنی اسیدهای سولفونیک با استفاده از تیونیل کلرید و معرف های مربوطه تولید می شوند.
جابجایی توسط هیدروکسیدویرایش کنید
پیوند (آریل)C - SO3- اگرچه قوی است، اما می تواند توسط معرف های نوکلئوفیل شکسته شود. از اهمیت تاریخی و مداوم، α سولفوناسیون آنتروکینون و به دنبال آن جابجایی گروه سولفونات توسط دیگر هسته دوست ها است که نمی توانند مستقیماً نصب شوند. [9] یک روش اولیه برای تولید فنل شامل هیدرولیز پایه بنزن سولفونات سدیم است که می تواند به راحتی از بنزن تولید شود. [12]
C 6 H 5 SO 3 Na + NaOH → C 6 H 5 OH + Na 2 SO 3
شرایط برای این واکنش سخت است، با این حال، برای خود اسید بنزن سولفونیک به «قلیا ذوب شده» یا هیدروکسید سدیم مذاب در دمای 350 درجه سانتیگراد نیاز دارد. [13] بر خلاف مکانیسم هیدرولیز قلیایی ذوب شده کلروبنزن، که از طریق حذف-افزودن ( مکانیسم بنزین) انجام می شود، اسید بنزن سولفونیک با یک مکانیسم SN Ar تحت تبدیل مشابهی قرار می گیرد ، همانطور که با برچسب 14 C، علی رغم عدم وجود جانشین های تثبیت کننده [14] اسیدهای سولفونیک با گروههای الکترونکشنده (مثلاً با جایگزینهای NO 2 یا CN) با سهولت بیشتری تحت این تبدیل قرار میگیرند.
اسید سولفونیک ، سولفونیک نیز سولفونیک نوشته می شود ، هر یک از یک کلاس اسیدهای آلی حاوی گوگرد و دارای فرمول کلی RSO 3 H ، که در آن R یک گروه ترکیبی آلی است. اسیدهای سولفونیک از مهمترین ترکیبات آلی سولفور هستند . اسیدهای آزاد به طور گسترده به عنوان کاتالیزور در سنتزهای آلی استفاده می شوند، در حالی که نمک ها و سایر مشتقات اساس ساخت مواد شوینده، رنگ ها و کاتالیزورهای محلول در آب ، داروسازی سولفونامید ، و رزین های تبادل یونی را تشکیل می دهند.. اسیدهای سولفونیک معطر به ویژه به عنوان مواد واسطه یا مواد اولیه در سنتز مفید هستند - به عنوان مثال، در تهیه فنل ها . گروه های اسید سولفونیک می توانند حلالیت ترکیبات در آب را تا حد زیادی افزایش دهند ، همانطور که در مورد مشتقات اسید سولفونیک تری فنیل فسفین (TPPTS)، P(C6H4 - m - SO3Na ) 3 دیده می شود. کمپلکس های فلزی این ترکیب به عنوان کاتالیزورهای همگن برای سنتز ترکیبات آلی در سیستم های دو فازی (مثلاً در مخلوط آب و یک حلال آلی) در صنعت و آزمایشگاه استفاده می شود.
چندین اسید سولفونیک به طور طبیعی وجود دارند - برای مثال، ماده مغذی ضروری تورین (اسید 2-آمینو اتان سولفونیک؛ NH 2 CH 2 CH 2 SO 3 H)، سولفوباسین ها و سایر سولفونولیپیدها (محصولات فعال بیولوژیکی از کشت های باکتریایی که حاوی 15 تا 17- هستند. زنجیره های کربنی متصل به کربن و نیتروژن اسید 2-آمینو اتان سولفونیک) و اسید اکینوسولفونیک C (یک اسید α-هیدروکسی سولفونیک حاوی دو حلقه ایندول برم دار). اسیدهای سولفونیک آلیفاتیک متان سولفونیک اسید و تری فلورومتان سولفونیک اسید (تریفلیک اسید؛ CF 3 SO 3ح) همچنین معرف ها و کاتالیزورهای مهم تجاری هستند. اسید تریفلیک، یکی از قوی ترین اسیدهای آلی شناخته شده، به عنوان کاتالیزور پلیمریزاسیون و در سلول های سوختی ، در تولید بنزین و در سنتز ترکیبات آلی و آلی فلزی استفاده می شود .
اسیدهای سولفونیک معطر عموماً از تیمار ترکیبات معطر با اسید سولفوریک غلیظ و تری اکسید گوگرد اضافه شده ("اولئوم") به دست می آیند که به این فرآیند سولفوناسیون می گویند . از آنجایی که اسیدهای سولفونیک اغلب به شکل نمک های سدیم آنها استفاده می شود، سولفوناسیون معمولاً با خنثی سازی با هیدروکسید سدیم یا کربنات سدیم دنبال می شود . چنین عملیاتی در مقیاس تولیدی در تهیه نمک های سدیم TPPTS (مورد استفاده در کاتالیزورها همانطور که در بالا توضیح داده شد)، در تهیه اسیدهای بنزن سولفونیک آلکیله شده (به عنوان شوینده های مصنوعی ) و در تهیه اسید آنتراکینون سولفونیک (مورد استفاده در) انجام می شود. ساخت آلیزارینو رنگهای دیگر).
جدید از بریتانیکا
دانشمندان بر این باورند که جمجمه های فسیل شده اقوام فیل که توسط یونانیان باستان پیدا شده است، اساس سیکلوپ اساطیری بوده است.
همه حقایق خوب را ببینید
از جمله روش های مختلفی که برای تهیه اسیدهای سولفونیک آلیفاتیک استفاده می شود، اکسیداسیون سایر ترکیبات آلی گوگردی، واکنش آلکیل هالیدها و سولفیت های فلزی، و واکنش ترکیبات آلی فلزی با کمپلکس های آمین تری اکسید گوگرد (مانند Me 3 NSO 3 ) می باشد. اسید تریفلیک از طریق فلوئوراسیون الکتروشیمیایی متان سولفونیل کلرید یا فلوراید ساخته می شود.
اسید سولفونیک
پلیمرهای پلی (اسید سولفونیک) و مشتقات آنها دسته دیگری با آویزهای اسیدی ترکیب شده هستند که گروه های سولفونات (-SO3H) هستند.
به مندلی اضافه کنید
حالت جامد 17O NMR مطالعات بیومولکول ها
آلن وانگ ، فابریزیا پولی ، در گزارش های سالانه در مورد طیف سنجی NMR ، 2014
4.4.4 اسیدهای سولفونیک
اسید سولفونیک ترکیبات آلی گوگردی حاوی S( O NMR است. حدود یک دهه بعد، وو و تیمش دو مطالعه دیگر را در مورد اسیدهای سولفونیک منتشر کردند. اولین کار O NMR و QCC هر اتم اکسیژن در گروه سولفونات را تجزیه و تحلیل کرد. O) 2 OH (سولفونیل هیدروکسید) هستند. در سال 2000، وو و همکاران [125] اولین تلاش برای مطالعه یک اسید سولفونیک، اسید p -toluenesulfonic، توسط حالت جامد 17 [130] بر تجزیه و تحلیل 17SO3−) تورین. در مورد دیگر [39] ، نویسندگان اندازه گیری های دمای متغیر 17 O NMR را برای بررسی دینامیک چرخشی گروه سولفونات در اسیدهای سولفونیک انجام دادند: تورین، هموتاورین و 4-آمینو بوتان-1-سولفونیک اسید (ABSA). تغییرات مشاهده شده در شکل خط پودری 17 O NMR ABSA از 253 تا 352 K ( شکل 3.18 )، نشان دهنده چرخش گروه های سولفونات حول پیوند CS است. به طور خاص،SO3−گروه تحت یک مکانیسم پرش چرخشی سه برابری با نرخ های 10 2 -10 5 s - 1 قرار می گیرد. این با ترکیب برازش طیفی با مدل نرخ پرش و هندسه چرخشی به دست میآید.
برای دانلود تصویر در اندازه واقعی وارد شوید
شکل 3.18 . آزمایشی (سمت چپ) و شبیه سازی شده (راست) طیف ثابت 17 O NMR با دمای متغیر از سه اکسیژن سولفونات در اسید 4-آمینو بوتان-1- سولفونیک (ABSA) در 21.1 T.
تجدید چاپ با اجازه از [39] .
لازم به ذکر است که، در حالی که پیشرفت قابل توجهی در حالت جامد 17 17 O NMR را برای بررسی دینامیک مولکولی مولکولهای آلی نشان میدهد و راه را برای زیست مولکولها هموار میکند.O NMR، تنها مطالعات کمی در مورد دینامیک مولکولی در جامدات و عمدتاً بر روی مواد معدنی وجود دارد. مطالعه وو در تیمهایش، برای اولین بار، توانایی حالت جامد را نشان میدهد.
آلاینده های آلی پایدار (POPs): تکنیک های تحلیلی، سرنوشت محیطی و اثرات بیولوژیکی
S. Michele Harmon ، در شیمی تحلیلی جامع ، 2015
5.1.3 سمیت PFOS برای دوزیستان
قرار گرفتن در معرض PFOS منجر به مقدار LC50 96 ساعته 13.8 میلی گرم در لیتر برای جنین قورباغه پنجه ای آفریقایی ( X. laevis ) شد [208] ، و دوزهای پایین (0.01 [222] . قورباغه های قورباغه پلنگ شمالی ( R. pipiens ) پس از قرار گرفتن در معرض 3 میلی گرم در لیتر PFOS رشد کاهش یافته و دگردیسی را به تاخیر انداختند، و مرگ و میر قابل توجهی در زمانی که قورباغه ها در معرض 10 میلی گرم در لیتر قرار گرفتند مشاهده شد [223] . mg/L) PFOS اثرات مختل کننده قابل توجهی در تولید هورمون تیروئید و هورمون جنسی برای همین گونه ایجاد کرد.
. مقادیر NOEC بر اساس آزمایشهای رشد 96 ساعته برای کلرلا ولگاریس
چند متراکم شدن
R. Guo ، JE McGrath ، در علم پلیمر: مرجع جامع ، 2012
5.17.4.1.2 (ii) تراکم مونومرهای اسید سولفونیک آروماتیک آزاد (اسیدهای آرن سولفونیک)
مونومرهای اسید سولفونیک همچنین می توانند برای تهیه پلی (آریلن اتر سولفون) با استفاده از اسیدهای قوی معمولی به عنوان کاتالیزور مانند (CF O، اسید پلی فسفریک (PPA)، MeSO از دی فنیل اتر ، که متعاقباً با دی فنیل اتر پلیمریزه می شود به عنوان کاتالیزور استفاده شود. پیش پلیمر با وزن مولکولی . کم آبی بیشتر این پیش پلیمرها می تواند وزن مولکولی بالایی در دمای 240 درجه سانتی گراد در اسید قوی مانند اسید پلی فسفریک ایجاد کند. با این حال، وجود گروه های اسید سولفونیک آزاد باعث می شود پلیمرها در مذاب به دلیل اتصال عرضی احتمالی ناپایدار شوند. پلیمرهای با وزن مولکولی از دی فنیل اتر و 4,4'-oxybenzenedisulfonic اسید به دست می آیند. 3 CO) 2 3 H–P 2 O 5 ، و CF 3 SO 3 H . در این نوع پلی تراکم ، یک اسید دی سولفونیک در محل 226 شکل 55 ). 227بعداً پلیمر محلول با وزن مولکولی بالا از طریق سولفوناسیون/پلیمریزاسیون یک مرحله ای دی فنیل اتر با استفاده از اسیدهای تنگستیک یا مولیبدیک به عنوان کاتالیزور به دست آمد.
شکل 55 . سولفوناسیون / چند تراکم دی فنیل اتر به پلی (آریلن اتر سولفون).
چندین محیط کم آبی دیگر نیز می تواند برای پلیمریزاسیون اسیدهای سولفونیک یا نمک های فلز قلیایی آنها استفاده شود . به عنوان مثال، MeSO 3 H-P 2 O 5 به عنوان یک محیط آبگیری مطلوب در تولید بهترین کیفیت PESs از پلیمریزاسیون اسید سولفونیک دی فنیل اتر با اسید 4،4'-oxybenzenedisulfonic گزارش شده است. 227
پیشرفت های اخیر در مواد میان ساختار
Chanho Pak , ... Doyoung Seung , in Studies in Surface Science and Catalysis , 2007
4 نتیجه گیری
گروه اسید سولفونیک با موفقیت به نمونه OMC بدون فروپاشی مزوساختار و تغییر اندازه مزوپور وارد شد. معرفی گروه اسید سولفونیک منجر به کاهش سطح نمونههای OMC شد. مقدار گروه اسید سولفونیک را می توان با تنظیم میزان نمک های سولفات آمونیوم استفاده شده در مرحله اشباع کنترل کرد بارگذاری درصد وزنی و فعالیت جرمی بهبود یافته برای واکنش اکسیداسیون متانول را در مقایسه با کاتالیزورهای تجاری PtRu نشان داد، که نشان می دهد نمونه OMC سولفونه شده می تواند به عنوان یک پشتیبانی کاتالیزور جدید برای DMFC استفاده شود.
پایش الکتروشیمیایی فعالیت فارماکولوژیکی محصولات طبیعی
Antonio Doménech-Carbó ، ... Gerardo Cebrián-Torrejón ، در مطالعات در شیمی محصولات طبیعی ، 2015
فهرست اختصارات
ABTS
۲،۲′-آزینو بیس(۳-اتیل بنزتیازولین-۶-سولفونیک اسید
AFM
میکروسکوپ نیروی اتمی
CE
واکنش شیمیایی قبل از مکانیسم انتقال الکترون
DMF
N ، N'- دی متیل فرمامید
DMSO
دی متیل سولفوکسید
DNA
اسید دئوکسی ریبونوکلئیک
dsDNA
اسید دئوکسی ریبونوکلئیک دو رشته ای
ssDNA
اسید دئوکسی ریبونوکلئیک تک رشته ای
DPPH
2،2-دی فنیل-1-پیکریل هیدرازیل
EC/MS
الکتروشیمی / طیف سنجی جرمی
EE
مکانیزم الکتروشیمیایی الکترون-الکترون
EIS
طیف سنجی امپدانس الکتروشیمیایی
GC
کربن شیشه ای (الکترود)
HeLa
Henrietta فاقد خطوط سلولی است، یک رده سلولی خاص انسان که به وفور در تحقیقات علمی استفاده می شود
HMDE
الکترود قطره جیوه آویزان
HX
هیپوگزانتین
ITO
اکسید قلع دوپ شده با ایندیم (الکترود)
NADPH
نیکوتین آمید دی نوکلئوتید فسفات
N-MOM
N-متوکسید
PBS
نمک فسفات بافر
ROS
گونه های اکسیژن واکنش پذیر
SAM ها
تک لایه های خود مونتاژ شده
SECM
میکروسکوپ الکتروشیمیایی روبشی
SOD
سوپراکسید دیسموتاز
STM
میکروسکوپ تونل زنی روبشی
ضربه زدن
پتانسیل آنتی اکسیدانی کل
XOD
گزانتین اکسیداز
از زئولیت ها تا مواد متخلخل MOF - چهلمین سالگرد کنفرانس بین المللی زئولیت
دیوید دوبه , سرژ کالیگوئین , در مطالعات علوم سطحی و کاتالیز , 2007
خلاصه
آلی سیلیس های مزوساختار دوره ای عامل دار شده با اسید سولفونیک (PMO) با استفاده از 1، 2-bis(triethoxysilyl)ethylene (BTENE) تحت شرایط اسیدی با استفاده از Pluronic 123 به عنوان سورفکتانت سنتز شدند . سپس پلهای اتیلن با بنزن با استفاده از AlCl3 به عنوان کاتالیزور آریله شدند. این مواد بیشتر با اسید سولفوریک برای سولفوناسیون قطعات فنیل تیمار شدند. ساختارهای شش ضلعی مرتب شده با مساحت سطح تا 440 متر بر گرم و توزیع اندازه منافذ باریک (حدود 5.3 نانومتر) به دست آمد. این کار نمونه ای از اصلاحات شیمیایی را برای مفهوم کاتالیزورهای PMO عاملدار جدید ارائه می دهد. بر
استفاده از غشای سولفونیک اسید پر فلوئور (PFSA) به عنوان الکترولیت در سلول های سوختی
مادلین اودگارد ، در مواد پیشرفته مبتنی بر فلوراید برای تبدیل انرژی ، 2015
14.3.4 مورفولوژی و رسانایی پروتون
مواد PFSA و غشاهای Nafion به طور گسترده مورد مطالعه قرار گرفته اند تا ارتباط بین مورفولوژی و انتقال پروتون را روشن کنند. [90-95] . خلاصه ای از مدل های مختلف پیشنهادی در ویرایش اول این کتاب توضیح داده شد [82] .
با استفاده از تعدادی تکنیک، از جمله پراکندگی پرتو ایکس با زاویه کوچک و گسترده و پراکندگی نوترونی ، میکروسکوپ الکترونی ، میکروسکوپ نیروی اتمی (AFM) [65،96-103] [ [107] ، رزونانس مغناطیسی هسته ای NMR) [108-113] ، و رزونانس اسپین الکترون (ESR)، مادون قرمز (IR)، و طیفسنجی رامان [114-116] ، چندین مدل برای توضیح ساختار غشاهای Nafion پیشنهاد شدهاند [117-119] .
مدلهای مختلفی برای تفسیر نتایج حاصل از این آزمایشها پیشنهاد شدهاند. آیزنبرگ [120] [117,121,122] ارائه شد. به دنبال این کار مدل های دیگری پیشنهاد شد، به عنوان مثال، "مدل شبکه کانال" توسط کریر [101] و مدل "کانال استوانه ای موازی" توسط اشمیت روهر و چن [123]وجود خوشه یونی را ارائه کرد و گسترده ترین مدل مرجع برای PFSA توسط Gierke ارائه شد.. اگرچه این مدلها در هندسه و توزیع فضایی خوشههای یونی متفاوت هستند، ویژگی مشترک آنها این است که یک جدایی فاز بین ستونهای آبگریز و زنجیرههای جانبی منتهی به اسید سولفونیک آبدوست وجود دارد که در خوشههای آب قرار دارند. اندازه و شکل خوشه های آبدوست به شدت به محتوای آب در مواد بستگی دارد.
مهمترین خاصیت غشای الکترولیت برای کاربرد PEMFC رسانایی پروتون است . غشاها باید یک مسیر یونی برای پروتون های تولید شده در آند به کاتد فراهم کنند. رسانایی پروتون پایین غشا باعث مقاومت اهمی بالا می شود. نقش استفاده از غشاهای نازکتر در کاربردهای FC دستیابی به عملکرد بالاتر FC است . کاهش مقاومت اهمی غشاء PFSA منجر به کاهش قابل توجه شیب در ناحیه شبه خطی منحنی عملکرد FC می شود، یعنی پتانسیل سلولی در مقابل چگالی جریان.
Nafion یک هادی پروتون عالی با رسانایی مشابه اسید سولفونیک 1.0 مولار است . پلیمر Nafion رفتاری شبیه به اسید آبی دارد به این معنا که محدود به عملکرد در دماهای کمتر از نقطه جوش آب است . رسانایی Nafion 0.08 است S cm -1 در 25 درجه سانتیگراد و رطوبت نسبی 100٪ (RH) است [124] .
رسانایی پروتون غشای پلیمری به طور گسترده در 30 مورد مطالعه قرار گرفته است [67,100,109,125-142] . چندین گروه تأثیر دما بر رسانایی Nafion را به تفصیل بررسی کرده اند. به طور کلی رسانایی پروتون با دما افزایش می یابد، اما به تغییر محتوای آب، یعنی تحرک پروتون نیز بستگی دارد، و از این رو مقاومت ویژه به سطح هیدراتاسیون مربوط می شود. در دماهای بالا غشاها تمایل به کم آبی دارند و رسانایی تمایل به کاهش دارد [100,128,130,131,136,143-149] سال، با استفاده از طیفسنجی امپدانس AC و تکنیکهای DC . رسانایی پروتون تنها زمانی می تواند با نرخ های دلخواه رخ دهد که غشای PFSA با آب هیدراته شود. در طول عملیات FC، سطح هیدراتاسیون ممکن است به دلیل یک حالت گذرا از عملکرد تغییر کند. حفظ هیدراتاسیون بهینه غشا نیاز به مدیریت بیشتر آب در یک سیستم FC مانند مرطوب کننده های هوا و سوخت، دستگاه های چرخش آب و غیره دارد که هزینه و پیچیدگی را به کل اضافه می کند.سیستم FC این روند در عملکرد FC عامل منعکس خواهد شد. شکل 14.9 منحنی های پلاریزاسیون FC تک سلولی را برای یک MEA بر اساس غشای 25 میکرومتری Nafion® 1100 -EW تقویت شده با PTFE نشان می دهد که در دمای 80 درجه سانتی گراد با (1) سطوح مختلف رطوبت از 40٪ RH تا 100٪ RH اندازه گیری شده است. (2) در دماهای مختلف در 40٪ RH.
برای دانلود تصویر در اندازه واقعی وارد شوید
شکل 14.9 . منحنی های پلاریزاسیون تک سلولی برای مجموعه الکترود غشایی (MEA) بر اساس غشای 25 میکرومتری Nafion® 1100 -EW اندازه گیری شده در دمای 80 درجه سانتی گراد با (الف) سطوح مختلف رطوبت از 40٪ RH تا 100٪ RH و (b) در دماهای مختلف در 40% RH.
بررسی ها و مقالات جامعی که خواص انتقال پروتون و درک اساسی تر از مکانیسم انتقال پروتون غشاهای PFSA و Nafion را با ترکیب داده های تجربی با مدل های حمل و نقل مکانیکی آماری غیرتعادلی پوشش می دهد، منتشر شده است. [90،101،150-160] .
حوزه های آبدوست هیدراته رسانایی بالایی را فراهم می کنند و بسیار به حضور آب بستگی دارند. غشای Nafion به دلیل ماهیت هیگروسکوپیک گروه اسید سولفونیک، آب را جذب می کند. آب در غشاء حداقل در سه مرحله مختلف وجود دارد (ref til mig selv). دو تا سه مولکول اول آب (به ازای هر گروه اسید سولفونیک) جذب شده توسط پلیمر تقریباً به طور کامل با گروههای اسیدی که پوسته هیدراتاسیون اولیه آن را تشکیل میدهند، تعامل دارند. این اولین مولکول های آب به شدت به یون ها متصل هستند. مولکولهای آب بعدی که وارد ماتریکس میشوند پیوند ضعیفتری دارند و میتوانند پروتونها را حل کنند و مرحله نهایی آب حجیم پر شده در ساختار منافذ باز است . انتقال پروتون Nafion ®در الکترولیت های پلیمری جامد از دو مکانیسم اصلی پیروی می کنند: یک جهش گروتوس مانند و یک مکانیسم "خودرو"[161-165] .
مکانیسم هدایت پروتون در غشاهای پرفلوئورینه کامل هیدراته شده توسط Kreuer و همکاران پیشنهاد شده است. [151] σ تقریباً از ضریب انتشار آب پیروی می کند.قابل مقایسه با آب مایع ضریب انتشار هدایت پروتون DDH2Oبرای Nafion به عنوان تابعی از دما و محتوای آب. پروتون ها عمدتاً در بخش مرکزی نانو کانال های آبدوست هیدراته قرار دارند. در این منطقه آب حجیم مانند با انتقال پروتون مشابه پروتون در آب مایع است. تصور می شود که انتقال پروتون در امتداد پیوندهای هیدروژنی شبکه آب رخ می دهد و جهش گروتوس به یک مکانیسم مهم انتقال تبدیل می شود. برای کاهش محتویات آب، جایی که آب از طریق فعل و انفعالات هیدروفیل/الکترواستاتیک با -SO محدودتر است.برای کاهش محتویات آب، جایی که آب از طریق برهمکنش های آبدوست/الکترواستاتیک با است ، تحرک پروتون کاهش می یابد و وابسته و با حرکت آب همکاری می کند. این حالت حرکت پروتون گاهی اوقات به عنوان «مکانیسم وسیله نقلیه» توصیف میشود، زیرا حرکت پروتونها به صورت کمپلکس رخ میدهد، به عنوان مثال، H 3 O + .
در 40 سال گذشته، غشاهای LSC PFSA مانند Nafion ® را بهبود میبخشد [65,146,166-179] .به دلیل پایداری شیمیایی و مکانیکی برتر ، معیار غشای یونومر PFSA بوده است. غشاهای دارای رسانایی پروتون بالا در RH پایین در دماهای بالا در حال حاضر کانون تحقیقات بسیاری هستند. غشاهای مبتنی بر SSC-PFSA پتانسیل امیدوارکننده ای را برای کاربرد PEMFC نشان می دهند. یونومرهای SSC از نظر تئوری می توانند با EW کمتر تهیه شوند و از این رو رسانایی پروتون بالاتری را بدون ایجاد تورم یا انحلال بیش از حد نشان می دهند. برای یک EW داده شده واحدهای TFE بیشتری در ستون فقرات زنجیره جانبی مرتب سازی شده در مقایسه با آنالوگ های LSC آن وجود دارد که درجه بلورینگی بالاتری را ارائه می دهد و در نتیجه مقاومت در برابر تورم در آب را بهبود می بخشد.
شکل 14.10 رسانایی اندازه گیری شده در سطوح مختلف رطوبت را برای یک غشای مبتنی بر SSC (750 EW) در مقایسه با غشای مبتنی بر LSC (1100 EW) نشان می دهد. در RH پایین غشاء با EW پایین رسانایی بالاتری نسبت به غشای high-EW نشان می دهد. در 40% RH غشاء 1100-EW دارای رسانایی 0.019 Scm - 1 بود ، در حالی که رسانایی غشاء 750-EW تحت شرایط مشابه 0.057 Scm - 1 بود .
شکل 14.10 . رسانایی بین غشای 1100-EW در طیفی از رطوبت نسبی (RH) در مقابل غشاء مبتنی بر 750-EW که در دمای 80 درجه سانتیگراد اندازهگیری شده بود، مقایسه شد.
چالش در توسعه غشا دستیابی به رسانایی پروتون عالی بدون به خطر انداختن خواص مکانیکی و شیمیایی است. اگرچه غشاهای SSC PFSA عملکرد بهبود یافته FC را با خواص مکانیکی نسبتاً خوب نشان می دهند، اما پایداری غشاهای مبتنی بر SSC می تواند نگرانی احتمالی برای کاربرد گسترده آنها در کاربردهای PEMFC باشد [71,180-182] .
TEXAPON®
مواد تشکیل دهنده لوازم آرایشی توسط BASF عرضه شده است
30 محصول با جستجوی شما مطابقت دارد
به تفصیلفهرست کنید
TEXAPON® ALS 70
BASF
آمونیوم لوریل سولفات. Texapon® ALS 70 توسط BASF یک سورفکتانت است. TEXAPON® ALS 70 در شامپوها و محصولات فوم حمام استفاده می شود... مشاهده بیشتر
TEXAPON® ALS BENZ
BASF
آمونیوم لوریل سولفات. TEXAPON® ALS BENZ توسط BASF یک سورفکتانت آنیونی است. TEXAPON® ALS BENZ در شامپوها، صابون های مایع، پاک کننده صورت و محصولات حمام/حمام استفاده می شود... مشاهده بیشتر
TEXAPON® ALS-IS
BASF
آمونیوم لوریل سولفات. TEXAPON® ALS-IS توسط BASF یک سورفکتانت آنیونی است. این ساختار فوم خوب و خواص شستشوی عالی را ارائه می دهد. TEXAPON® ALS-IS در محصولات مایع استفاده می شود ... مشاهده بیشتر
TEXAPON® ASV 50
BASF
Sodium Laureth Sulfate (و) Sodium Laureth 8-Sulfate (و) Magnesium Laureth Sulfate (و) منیزیم Laureth 8-Sulfate (و) Sodium Oleth Sulfate (و) سولفات منیزیم Oleth. TEXAPON® ASV 50 by... مشاهده بیشتر
TEXAPON® ASV 70 SPECIAL
BASF
Sodium Laureth Sulfate (و) Sodium Laureth-8 Sulfate (و) Sodium Oleth Sulfate. TEXAPON® ASV 70 SPECIAL توسط BASF یک سورفکتانت است. TEXAPON® ASV 70 SPECIAL در مراقبت و پاکسازی نوزاد کاربرد دارد... مشاهده بیشتر
TEXAPON® آسان
BASF
کوکو سولفات سدیم (و) لوریل گلوکوزید. TEXAPON Easy by BASF یک سورفکتانت است. این مخلوطی از سولفات الکل چرب سدیم C12-16 و آلکیل گلوکوزید است. TEXAPON® Easy هندلینگ بهبود یافته را ارائه می دهد... مشاهده بیشتر
TEXAPON® K 12 G
BASF
سدیم لوریل سولفات. TEXAPON® K 12 G توسط BASF یک سورفکتانت آنیونی است. TEXAPON® K 12 G در خمیر دندان، دهانشویه و محصولات دوش/حمام استفاده می شود... مشاهده بیشتر
TEXAPON® K 12 P
BASF
سدیم لوریل سولفات. TEXAPON® K 12 P توسط BASF یک سورفکتانت آنیونی است. TEXAPON® K 12 P در خمیردندان ها، دهانشویه ها و محصولات دوش/حمام کاربرد دارد... مشاهده بیشتر
TEXAPON® K 14 S SPEC 70%
BASF
سدیم میرت سولفات. TEXAPON® K 14 S SPEC 70% BASF یک سورفکتانت آنیونی است. TEXAPON® K 14 S SPEC 70% در مراقبت و پاکسازی نوزاد، پاکسازی صورت و محصولات حمام/حمام، مایع... مشاهده بیشتر
TEXAPON® K 14 S Special
BASF
سدیم میرت سولفات. TEXAPON® K 14 S Special by BASF یک سورفکتانت پایه است. سازگاری پوستی خوبی را ارائه می دهد. TEXAPON® K 14 S Special در آماده سازی های پاک کننده ملایم کاربرد دارد... مشاهده بیشتر
TEXAPON® K 30 UP
BASF
کوکویل سولفات سدیم. TEXAPON® K 30 UP توسط BASF یک سورفکتانت آنیونی است. TEXAPON® K 30 UP در مراقبت و پاکسازی کودک، صابون های مایع، محصولات حمام/حمام، پاک کننده صورت، شامپوها و... استفاده می شود .
TEXAPON® LS 30
BASF
سدیم لوریل سولفات. TEXAPON® LS 30 توسط BASF یک سورفکتانت آنیونی است. این یک الکل سولفات سدیم C12-14 است. TEXAPON® LS 30 در فرمولاسیون شامپو، مراقبت از کودک و پاکسازی کاربرد دارد... مشاهده بیشتر
TEXAPON® LS 35
BASF
سدیم لوریل سولفات. TEXAPON® LS 35 توسط BASF یک سورفکتانت پایه است. خاصیت کف کنندگی دارد. TEXAPON® LS 35 در فرمولاسیون های پاک کننده آرایشی استفاده می شود... مشاهده بیشتر
TEXAPON® MC 120
BASF
سدیم لورت سولفات (و) کوکامید MEA. TEXAPON® MC 120 توسط BASF یک سورفکتانت آنیونی است. مخلوطی از اتر سولفات سدیم C12-14 با تقریباً 2 EO و اسید چرب نارگیل... مشاهده بیشتر
TEXAPON® MG
BASF
منیزیم لورت سولفات. TEXAPON® MG توسط BASF یک سورفکتانت آنیونی است. این یک اتر سولفات منیزیم C12-14 است. TEXAPON® MG در فرمولاسیون شامپوها، مراقبت از کودک و پاکسازی، مایع... مشاهده بیشتر
TEXAPON® MG IS
BASF
منیزیم لورت سولفات. TEXAPON® MG IS توسط BASF یک سورفکتانت آنیونی ملایم است. دارای خواص کف است. TEXAPON® MG IS برای تهیه شامپو، حمام فوم و سایر لوازم آرایشی استفاده می شود... مشاهده بیشتر
TEXAPON® MLS
BASF
MEA-لوریل سولفات. TEXAPON® MLS توسط BASF یک سورفکتانت آنیونی است. TEXAPON® MLS در شامپوها، آماده سازی حمام و حمام و پاک کننده های پوست کاربرد دارد... مشاهده بیشتر
TEXAPON® N 40 IS
BASF
سدیم لورت سولفات. TEXAPON® N 40 IS توسط BASF یک سورفکتانت آنیونی است. TEXAPON® N 40 IS در شامپوها و حمام های حبابی کاربرد دارد... مشاهده بیشتر
TEXAPON® N 70
BASF
سدیم لورت سولفات. TEXAPON® N 70 توسط BASF یک سورفکتانت آنیونی است. TEXAPON® N 70 مناسب برای شامپو، مراقبت و پاکسازی کودک، صابون مایع، پاک کننده صورت و محصولات دوش/حمام... مشاهده بیشتر
TEXAPON® N 701
BASF
سدیم لورت سولفات. TEXAPON® N 701 توسط BASF یک سورفکتانت آنیونی است. TEXAPON® N 701 در شامپوها، مراقبت و پاکسازی کودک، صابون های مایع، پاک کننده صورت و محصولات دوش/حمام استفاده می شود... مشاهده بیشتر
TEXAPON® NA
BASF
آمونیوم لورت سولفات. TEXAPON® NA توسط BASF یک سورفکتانت آنیونی است. TEXAPON® NA در شامپو، ژل دوش و حمام فوم استفاده می شود... مشاهده بیشتر
TEXAPON® NSO
BASF
سدیم لورت سولفات. TEXAPON® NSO توسط BASF یک سورفکتانت اساسی و عامل کف کننده است. دارای خاصیت شوینده و پاک کنندگی فوق العاده و قابلیت غلیظ شدن آسان با نمک... مشاهده بیشتر
TEXAPON® PLT 270
BASF
سدیم لورت سولفات. TEXAPON® PLT 270 توسط BASF یک سورفکتانت آنیونی است. TEXAPON® PLT 270 در شامپوها و حمام های دوش کاربرد پیدا می کند... مشاهده بیشتر
TEXAPON® SB 3 KC
BASF
دی سدیم لورت سولفوسوکسینات. TEXAPON® SB 3 KC توسط BASF یک سورفکتانت آنیونی است. TEXAPON® SB 3 KC در شامپوها، مراقبت و پاکسازی کودک، صابون های مایع، پاک کننده صورت و دوش/حمام استفاده می شود... مشاهده بیشتر
TEXAPON® SFA
BASF
دی سدیم 2- سولفورات. TEXAPON® SFA توسط BASF یک سورفکتانت آنیونی 100٪ زیست تخریب پذیر طبیعی است. به عنوان یک عامل ضخیم کننده مایسل استفاده می شود. برای پوست و غشای مخاطی بسیار خفیف است. ارائه می دهد ... مشاهده بیشتر
TEXAPON® SPN 70
BASF
سدیم لوریل سولفات. TEXAPON® SPN 70 توسط BASF یک عامل مرطوب کننده است. این خاصیت پخش کنندگی خوب و عملکرد کف کنندگی مشخص را نشان می دهد. TEXAPON® SPN 70 در فرمولاسیون های آرایشی... مشاهده بیشتر
TEXAPON® T 42
BASF
چای-لوریل سولفات. TEXAPON® T 42 توسط BASF یک سورفکتانت آنیونی است. TEXAPON® T 42 در پاکسازی صورت، صابون های مایع، شامپوها و فرمولاسیون های حمام/حمام کاربرد پیدا می کند... مشاهده بیشتر
TEXAPON® V 95 G
BASF
سدیم لوریل سولفات. TEXAPON® V 95 G توسط BASF یک سورفکتانت آنیونی است. TEXAPON® V 95 G در خمیر دندان، غرغره دهان و محصولات حمام استفاده می شود... مشاهده بیشتر
TEXAPON® WW 100
BASF
MIPA-Laureth Sulfate (و) Laureth-4 (و) Cocamide DEA. TEXAPON® WW 100 توسط BASF یک سورفکتانت است. دارای خواص تقویت کننده لایه چربی است. TEXAPON® WW 100 در روغن های آرایشی و بهداشتی، فوم روغنی ... مشاهده بیشتر
TEXAPON® Z 95 P
BASF
کوکویل سولفات سدیم. TEXAPON® Z 95 P توسط BASF یک سورفکتانت آنیونی است. TEXAPON® Z 95 P در خمیر دندان، غرغره دهان و محصولات حمام استفاده می شود... مشاهده بیشتر
تگزاپون
با نام علمی سدیم لوریل اتر سولفات و فرمول مولکولی NaC12H25SO4، خمیری نیمه شفاف سفید یا غلیظ زرد با بوی ملایم است.
تگزاپون به راحتی و به هر نسبتی در آب حل می شود و در مقایسه با آب سخت از پایداری بالایی برخوردار است. سدیم لوریل اتر سولفات با نام تجاری Texapon شناخته می شود که یک سورفکتانت آنیونی است و یکی از رایج ترین ترکیبات شیمیایی است.
Texapon به دو شکل N70 و صدف موجود است. صدف های تگزاپون خلوص کمتری نسبت به N70 دارند و در تولید مواد شوینده صدفی و مات مانند شامپو استفاده می شود. Texapon N70 یک خمیر با ویسکوزیته بالا است که در تولید مواد شوینده شفاف استفاده می شود.
حاوی مقدار کمی نمک است که با رقیق شدن در آب در غلظت های معمولی ویسکوزیته پایینی از خود نشان می دهد و وقتی کلرید سدیم و سورفکتانت آلکانول آمید به آن اضافه شود ویسکوزیته آن تنظیم می شود. نرمی تگزاپون در ترکیب با بتائین بیشتر از نرمی هر کدام به تنهایی است.
کاربردهای تگزاپون:
به عنوان یک شوینده رایج در اکثر محصولات بهداشتی سر و بدن استفاده می شود. خاصیت کف کنندگی خوبی دارد، خاصیت کف کنندگی خوبی دارد اما کف آن سبک و کرمی نیست و در مجاورت چربی از بین می رود و در آب سخت و معمولی با کف زیاد به راحتی حل می شود و با سایر مواد افزودنی سازگار است. . با استفاده از این ماده می توان به راحتی و بدون نیاز به حرارت دادن و هم زدن با سرعت بالا با افزودن سایر موارد بسته به فرمولاسیون به نتیجه دلخواه رسید.
ماهیت تحریک کننده پوست دارد و به ساختار دو لایه چربی پوست آسیب می رساند و باعث افزایش تبخیر ظریف پوست و خشکی آن می شود. بنابراین در صورت ترکیب با سایر سورفکتانت های آنیونی، آمفوتریک و غیر یونی کیفیت و میزان کف و شستشو در سطح مطلوبی فراهم می شود. همچنین در صورت نیاز می توان آن را با تری اتانولامین رقیق کرد. در اکثر شوینده های تجاری مانند مایع ظرفشویی و شوینده های صنعتی (کف شوینده، مایع کارواش، روغن پاک کن) استفاده می شود و در بیش از 90 درصد مواد بهداشتی و شوینده مانند خمیر دندان، صابون، شامپو، کرم و لوسیون کف کننده است. مایع پاک کننده و یکی از مواد اولیه لوازم آرایشی است.
تولید تگزاپون
تگزاپون از طریق اتوکسیداسیون یک الکل چرب مانند روغن نارگیل تولید می شود. در نتیجه به نیمه استر اسید سولفوریک تبدیل شده و با تبدیل آن به نمک سدیم خنثی می شود.
زمان نگهداری:
در شرایط عادی تا یک سال قابل نگهداری است. از یخ زدن خودداری کنید.
مضرات تگزاپون:
آسیب پوست: سدیم لوریل سولفات و سایر سورفکتانت های آنیونی به طور گسترده به بافت پوششی پوست آسیب می رسانند. در واقع، بیشتر واکنش های پوستی به محصولات بهداشتی به دلیل سورفکتانت های موجود در آنها است. این ترکیب همچنین دارای خواص مخربی است که اغلب به عمد در آزمایشات بالینی برای تخریب پوست استفاده می شود.
در مطالعه ای که به منظور تعیین تفاوت انحطاط از نظر جنسیت و نژاد انجام شد، میزان اتلاف بخار آب از طریق پوست ناشی از سدیم لوریل سولفات به عنوان روشی مفید در ارزیابی اثرات مخرب تگزاپون به صورت واکنش های آلرژیک در پوست ظاهر شد. مردم. در مطالعه ای روی 242 بیمار مبتلا به درماتیت اگزما، واکنش های آلرژیک زیادی به سدیم لوریل سولفات مشاهده شد.
تماس مکرر با سدیم لوریل سولفات باعث درماتیت تماسی مخرب می شود و آن را به یک بیماری شایع شغلی تبدیل می کند. تحقیقات نشان می دهد که سدیم لوریل سولفات به شدت به یکپارچگی کلی پوست آسیب می رساند.
دانشمندان استفاده از پاک کننده های دیگر را که تاثیر کمتری بر قوام کلی پوست دارند توصیه نمی کنند.
آسیب دهان: سدیم لوریل سولفات نه تنها به لایه اپیدرمی پوست آسیب می رساند، بلکه برای مخاط دهان نیز بسیار مضر است. این مهم است زیرا این ترکیب اغلب در خمیر دندان استفاده می شود. مطالعات نشان می دهد که سدیم لوریل سولفات یک ترکیب مضر برای بافت های دهان است. بسیاری از افرادی که از بیماری های مخاطی دهان رنج می برند تا حد زیادی به دلیل وجود سدیم لوریل سولفات در خمیر دندان و ترکیباتی است که آنها استفاده می کنند. سدیم لوریل سولفات قطعا بیماری های مخاطی دهان را تشدید می کند.
مطالعات نشان می دهد که اثرات مخرب سدیم لوریل سولفات بر پروتئین های موجود در مخاط دهان باعث افزایش بروز آفات می شود. مطالعات دیگر نشان می دهد که افراد مبتلا به کم کاری تیروئید باید از سیگار کشیدن اجتناب کنند و از خمیر دندان حاوی سدیم لوریل سولفات استفاده کنند.
تولید تگزاپن/فرمول تولید تگزاپن N70/فرمولاسیون ساخت تگزاپن/روش ساخت تگزاپن
روش تولید تگزاپن/فرمول ساخت تگزاپنN70/فرمولاسیون تگزاپن/تولید آسان تگزاپن
طرز ساخت تگزاپن(N70/N30)/فرمول تولید تگزاپن/فرمولاسیون ساخت تگزاپن/روش تولید تگزاپن N70
مایع دستشویی بدون تگزاپن/روش تولید مایع دستشویی بدون نیاز به تگزاپن